La « Rédaction médicale Vigilance »
Forte d’une expérience de près de 10 années dans le domaine de la vigilance, et entourée de collaborateurs experts dans leur métier, Vigilance 360 a développé un pôle d’expertise « Rédaction Médicale Vigilance ». Ce dernier a pour but de répondre aux besoins des entreprises de santé soumises à des obligations réglementaires toujours plus fortes.
Evolution du Rédacteur Médical Vigilance
Depuis l’introduction des GVP (Good Pharmacovigilance Practices), le rôle du Rédacteur Médical Vigilance a évolué : il doit non seulement maitriser les documents de vigilance mais également posséder les compétences nécessaires pour :
- Traiter, avec des équipes pluridisciplinaires, des données complexes
- S’engager au respect des délais stricts
Le Rédacteur Médical Vigilance joue donc un rôle crucial dans la production des rapports de sécurité, et dans leur gestion. Il est le garant que les documents sont produits de manière efficiente, avec un haut niveau de qualité et dans le strict respect des délais.
Au sein de nos équipes, les Rédacteurs Médicaux Vigilance 360 vous apportent :
- Leur expertise en matière de vigilance
- Leur connaissance approfondie des exigences réglementaires
- Leur expertise en matière de format et de contenu des rapports
- Leurs compétences en matière de rédaction, de communication et de gestion de projet
Une équipe de surveillance et traitement des données

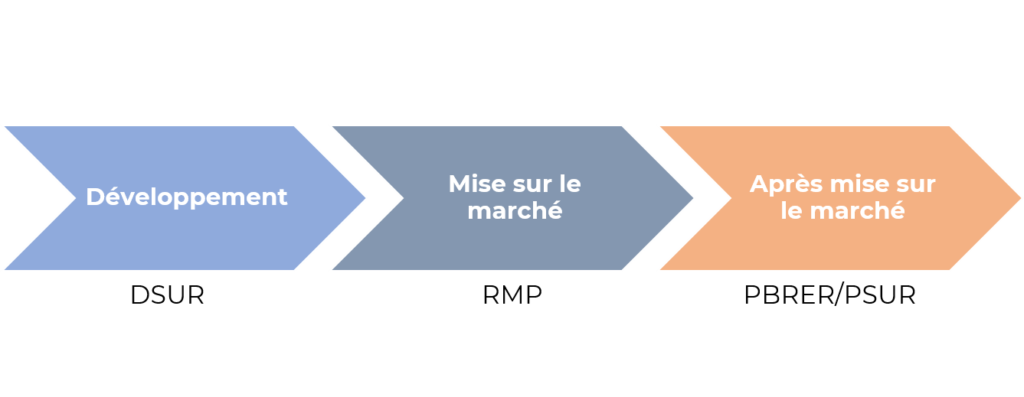
La surveillance des données de sécurité est une activité hautement réglementée qui doit couvrir tout le cycle de vie du produit, des premières étapes de développement clinique jusqu’à l’arrêt de commercialisation ou retrait du marché.
Cette surveillance permettant une détection précoce des signaux de sécurité, contribue à une amélioration de la sécurité des patients.
Au sein de l’équipe Projet que nous mettons en place, les données de sécurité collectées sont analysées et nous communiquons les résultats aux autorités sanitaires via les différents documents réglementaires attendus :
- le DSUR *, rapport périodique global de mise à jour de la sécurité du développement
- le RMP**, plan de gestion des risques
- le PBRER*** ou PSUR****, rapport périodique d’évaluation des risques liés aux bénéfices
La garantie de professionnels de santé expérimentés
Notre pôle « Rédaction Médicale Vigilance » est composé de médecins, de pharmaciens et de professionnels des sciences de la vie, experts en vigilance et en rédaction médicale. Ils sont en mesure de vous fournir un accompagnement complet dans la préparation et la rédaction de ces documents, pour tout type de produit.
Nos collaborateurs possèdent une solide formation académique, une connaissance approfondie de la législation, des années d’expérience dans la vigilance en recherche clinique ou spontanée pour de grandes et moyennes entreprises pharmaceutiques, des fabricants de dispositifs médicaux, des biotechs …
Les documents sont rédigés conformément aux textes en vigueur, règlementations locales et Européennes, guides ICH, normes ISO, … . Les procédures mises en place intégrant notamment les plans génériques de rapport et circuits de relecture garantissent l’atteinte des standards Qualité exigés aussi bien par les Autorités que par les Clients.
Les interactions régulières entre nos Clients et leur interlocuteur privilégié VIGILANCE 360 apportent une visibilité totale sur la conduite du projet et permettent d’établir une relation solide et pérenne.
*Development Safety Update Report
** Risk Management Plan
*** Periodic Benefit Risk Evolution Report
**** Periodic Safety Update Report